El president del govern espanyol, Pedro Sánchez, ha anunciat aquest dilluns que l'Agència Espanyola del Medicament ha autoritzat aquest dilluns l'assaig clínic en fase 2 de la vacuna de l'empresa catalana HIPRA contra el covid-19. Es durà a terme a 10 centres hospitalaris amb més de 1.000 voluntaris, i disposarà d'una ajuda de 15 milions d'euros del govern espanyol, tal com va aprovar fa dues setmanes el Consell de Ministres.
Els hospitals seran: Trueta, Clínic, Vall d'Hebron, Can Ruti, Clínic de València, la Paz, Gregorio Marañon, Príncipe de Asturias, Cruces, i el regional de Màlaga. Seran 1.000 voluntaris vacunats amb pauta completa de Pfizer dels quals la meitat rebran la vacuna d'HIPRA i l'altra meitat la de Pfizer. L'objectiu és estudiar si la vacuna HIPRA és una bona opció com a dosi de reforç.
Segons Sánchez, aquesta és una "notícia extraordinària" per a la ciència, ha dit, que "demostra que Espanya es pot situa a l'avantguarda de la resposta davant el covid"."És un motiu més per sentir orgull de país, defensar el paper de la ciència, apostar per la col·laboració público-privada" com es fa, a dit, al PERTE que ha presentat aquest dilluns.
Sánchez ha fet aquestes manifestacions durant la presentació dels Projectes Estratègics per a la Recuperació i Transformació Econòmica (PERTE) en medicina d'avantguarda, en un acte on també ha participat les ministres d'Hisenda, Indústria, Sanitat i Ciència.
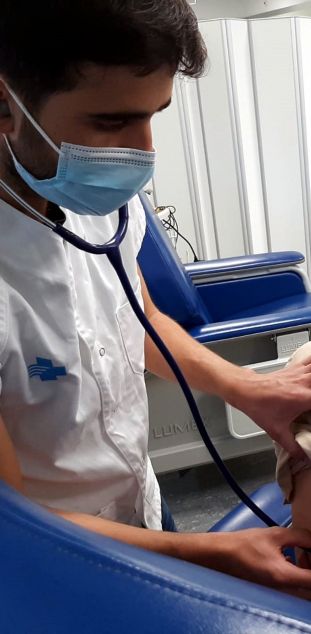
Un infermer auscultant una persona voluntària abans de l'administració de la vacuna
contra la covid-19 d'Hipra, en el marc de la fase I/IIa de l'assaig clínic en humans.
Vacuna de reforç
Segons informa l'Agència Espanyola de Medicaments i Productes Sanitaris (AEMPS) l'objectiu de l'assaig és "avaluar la seguretat i la capacitat de generar una resposta immune" d'una vacuna de reforç en adults que hagin rebut la pauta complerta de Cominarty (la vacuna de Pfizer/BioNTech). Aquesta segona fase de l'assaig es farà a deu centres hospitalaris i comptarà amb uns 1.100 voluntaris.
Per autoritzar l'estudi, s'ha tingut en compte que a la fase I de l'assaig (que l'AEMPS va aprovar a l'agost) no s'han apreciat problemes de seguretat del vaccí d'Hipra, i que tan sols s'han trobat "les reaccions que eren esperables" de qualsevol vacuna. En aquesta primera fase, cada participant va rebre dues dosis amb 21 dies de diferència. A partir d'aquesta segona injecció, se'ls fa seguiment durant 48 setmanes.
"A més, també s'ha avaluat la capacitat d'induir una resposta immune creant anticossos contra totes les variants del virus SARS-CoV-2 (alfa, beta, gamma i delta) i, en particular, d'anticossos netrualitzants", concreta l'agència del medicament.
L'AEMPS precisa que aquesta segona fase de l'assaig (batejada com a IIb) es farà de manera aleatòria i que els voluntaris rebran o bé la vacuna d'Hipra o bé una altra de manera "emmascarada"; és a dir, que ni el pacient ni l'equip investigador sabran quina és. Els diferents centres hospitalaris començaran en breu a seleccionar els voluntaris. Tots ells hauran rebut dues dosis de la vacuna de Pfizer. L'última, com a mínim des de fa 182 dies; i com a màxim, des de fa un any.
La vacuna d'Hipra es basa en dues proteïnes recombinants estructuralment similars (una correspon a la variant alfa i l'altra, a la beta). Les dues s'uneixen formant una estructura -que s'anomena dímer- i que s'acompanya d'un component que incrementa la resposta immunològica.
"Aquesta combinació és capaç de generar una resposta davant una de les proteïnes del virus SARS-CoV-2, coneguda com a proteïna S", concreta l'AEMPS. Aquesta plataforma, tot i que té proteïnes de dures variants diferents de la covid-19, és la mateixa que s'ha fet servir per a la vacuna de Novavax (que està en procés d'avaluació per part de l'Agència Europea del Medicament).



Comentaris (1)