El presidente del gobierno español, Pedro Sánchez, ha anunciado este lunes que la Agencia Española del Medicamento ha autorizado este lunes el ensayo clínico en fase 2 de la vacuna de la empresa catalana HIPRA contra el covid-19. Se llevará a cabo en 10 centros hospitalarios con más de 1.000 voluntarios, y dispondrá de una ayuda de 15 millones de euros del gobierno español, tal como aprobó hace dos semanas el Consejo de Ministros.
Los hospitales serán: Trueta, Clínico, Valle de Hebron, Can Ruti, Clínico de Valencia, la Paz, Gregorio Marañon, Príncipe de Asturias, Cruces, y el regional de Málaga. Serán 1.000 voluntarios vacunados con pauta completa de Pfizer de los cuales la mitad recibirán la vacuna de HIPRA y la otra mitad la de Pfizer. El objetivo es estudiar si la vacuna HIPRA es una buena opción como dosis de refuerzo.
Según Sánchez, esta es una "noticia extraordinaria" para la ciencia, ha dicho, que "demuestra que España se puede sitúa en vanguardia de la respuesta ante el covid"."Es un motivo más para sentir orgullo de país, defender el papel de la ciencia, apostar por la colaboración público-privada" cómo se hace, a dedo, al PERTE que ha presentado este lunes.
Sánchez ha hecho estas manifestaciones durante la presentación de los Proyectos Estratégicos para la Recuperación y Transformación Económica (PERTE) en medicina de vanguardia, en un acto donde también ha participado las ministras de Hacienda, Industria, Sanidad y Ciencia.
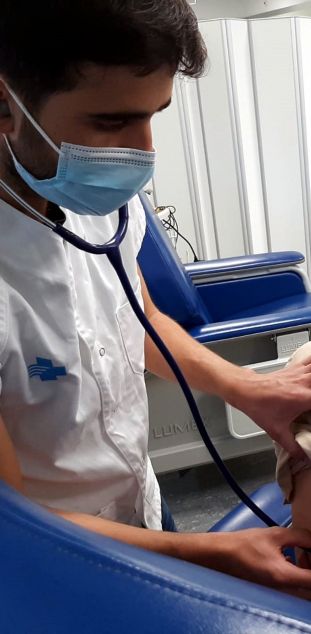
Un enfermero auscultant una persona voluntaria antes de la administración de la vacuna
contra la covid-19 de Hipra, en el marco de la fase Y/IIa del ensayo clínico en humanos.
Vacuna de refuerzo
Según informa la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) el objetivo del ensayo es "evaluar la seguridad y la capacidad de generar una respuesta inmune" de una vacuna de refuerzo en adultos que hayan recibido la pauta cumplida de Cominarty (la vacuna de Pfizer/BioNTech). Esta segunda fase del ensayo se hará a diez centros hospitalarios y contará con unos 1.100 voluntarios.
Para autorizar el estudio, se ha tenido en cuenta que a la fase Y del ensayo (que el AEMPS aprobó en agosto) no se han apreciado problemas de seguridad del vaccí de Hipra, y que tan solo se han encontrado "las reacciones que eran esperables" de cualquier vacuna. En esta primera fase, cada participante recibió dos dosis con 21 días de diferencia. A partir de esta segunda inyección, se los hace seguimiento durante 48 semanas.
"Además, también se ha evaluado la capacidad de inducir una respuesta inmune creando anticuerpos contra todas las variantes del virus SARS-CoV-2 (alfa, beta, gamma y delta) y, en particular, de anticuerpos netrualitzants", concreta la agencia del medicamento.
El AEMPS precisa que esta segunda fase del ensayo (bautizada como IIb) se hará de manera aleatoria y que los voluntarios recibirán o bien la vacuna de Hipra o bien otra de manera "enmascarada"; es decir, que ni el paciente ni el equipo investigador sabrán cuál es. Los diferentes centros hospitalarios empezarán en breve a seleccionar los voluntarios. Todos ellos habrán recibido dos dosis de la vacuna de Pfizer. La última, como mínimo desde hace 182 días; y como máximo, desde hace un año.
La vacuna de Hipra se basa en dos proteínas recombinantes estructuralmente similares (una corresponde a la variante alfa y la otra, a la beta). Las dos se unen formando una estructura -que se denomina dímero- y que se acompaña de un componente que incrementa la respuesta inmunológica.
"Esta combinación es capaz de generar una respuesta ante una de las proteínas del virus SARS-CoV-2, conocida como proteína S", concreta la AEMPS. Esta plataforma, a pesar de que tiene proteínas de duras variantes diferentes de la covid-19, es la misma que se ha usado para la vacuna de Novavax (que está en proceso de evaluación por parte de la Agencia Europea del Medicamento).



Comentarios (1)